Técnicas Avançadas de Espermograma
Curso intensivo para profissionais de laboratório que desejam dominar técnicas avançadas de análise espermática, unindo teoria e prática em um dia de imersão.
Turmas
Preencha o formulário para fazer parte da lista de espera. Quando abrirmos uma nova data, iremos entrar em contato com você.
Formulário para inscrição gratuita no curso
10x R$ 200
Inscrição Gratuita
Nível:
Avançado
Duração:
8 horas
Modalidade:
Presencial
Certificado:
Sim
Professor(es)

Luciana Issas de Oliveira
Bióloga formada pela UNESP com mais de 30 anos de experiência em reprodução humana, especialização em genética médica e em controle de qualidade de laboratório de FIV. Título de embriologista pelo CRBio.

Luana Rodrigues
Embriologista pelo Centro Universitário Internacional e Instituto GERA, Biomédica habilitada em Análises Clínicas pela Universidade Paulista.

Ingrid Sene Rosa
Biomédica pela Faculdade Mogi das Cruzes com pós-graduação pela UNINTER e práticas em laboratório de reprodução assistida pelo Instituto GERA
O curso Técnicas Avançadas de Espermograma prepara o participante para realizar e interpretar o exame de forma completa, combinando os critérios da OMS com testes complementares modernos. Em 8 horas (4h teóricas e 4h práticas), serão abordadas desde a coleta correta e análise detalhada até técnicas avançadas como fragmentação do DNA e seleção espermática por microfluídica (ZyMot), sempre com aplicação direta em reprodução assistida.
Tópicos Teóricos (4h)
- Indicações do espermograma e preparo da amostra – abstinência, coleta por masturbação e importância do tempo para análise
- Critérios da OMS para normalidade
- Análise macroscópica do sêmen – parâmetros (cor, volume, viscosidade, pH, tempo de liquefação) e interpretação de resultados
- Análise microscópica – técnicas de contagem em câmaras, avaliação da motilidade (tipos A, B, C, D), concentração, vitalidade e morfologia estrita de Kruger
- Testes de vitalidade e integridade de membrana – princípios do teste de eosina-nigrosina e do teste hiposmótico; quando solicitá-los e como interpretar
- Identificação de células redondas e teste de peroxidase – diferenças entre espermatogônias e leucócitos; uso da coloração peroxidase para detectar granulócitos
- Morfologia estrita de Kruger – critérios para cabeça, peça intermediária, cauda e acrossoma; importância da morfologia para prognóstico; valores de referência (≥ 4 % formas normais)
- Testes complementares:
- Fragmentação do DNA espermático: causas, indicação do teste TUNEL/citometria de fluxo, interpretação dos resultados e impacto na fertilidade
- Tecnologia ZyMot: princípios da microfluídica, indicações (oligozoospermia, astenozoospermia, alta fragmentação), comparação com métodos de centrifugação
- Relevância clínica dos resultados – classificação de alterações (oligozoospermia, astenozoospermia, teratozoospermia), relação com patologias como varicocele e infecções, e encaminhamento para técnicas de reprodução assistida (IIU, FIV, ICSI)
Tópicos Práticos (4h)
- Coleta e processamento da amostra – demonstração de salas de coleta, instruções ao paciente, registro de dados e manuseio da amostra
- Avaliação macroscópica passo a passo – medição de volume e tempo de liquefação, avaliação de viscosidade, cor e pH
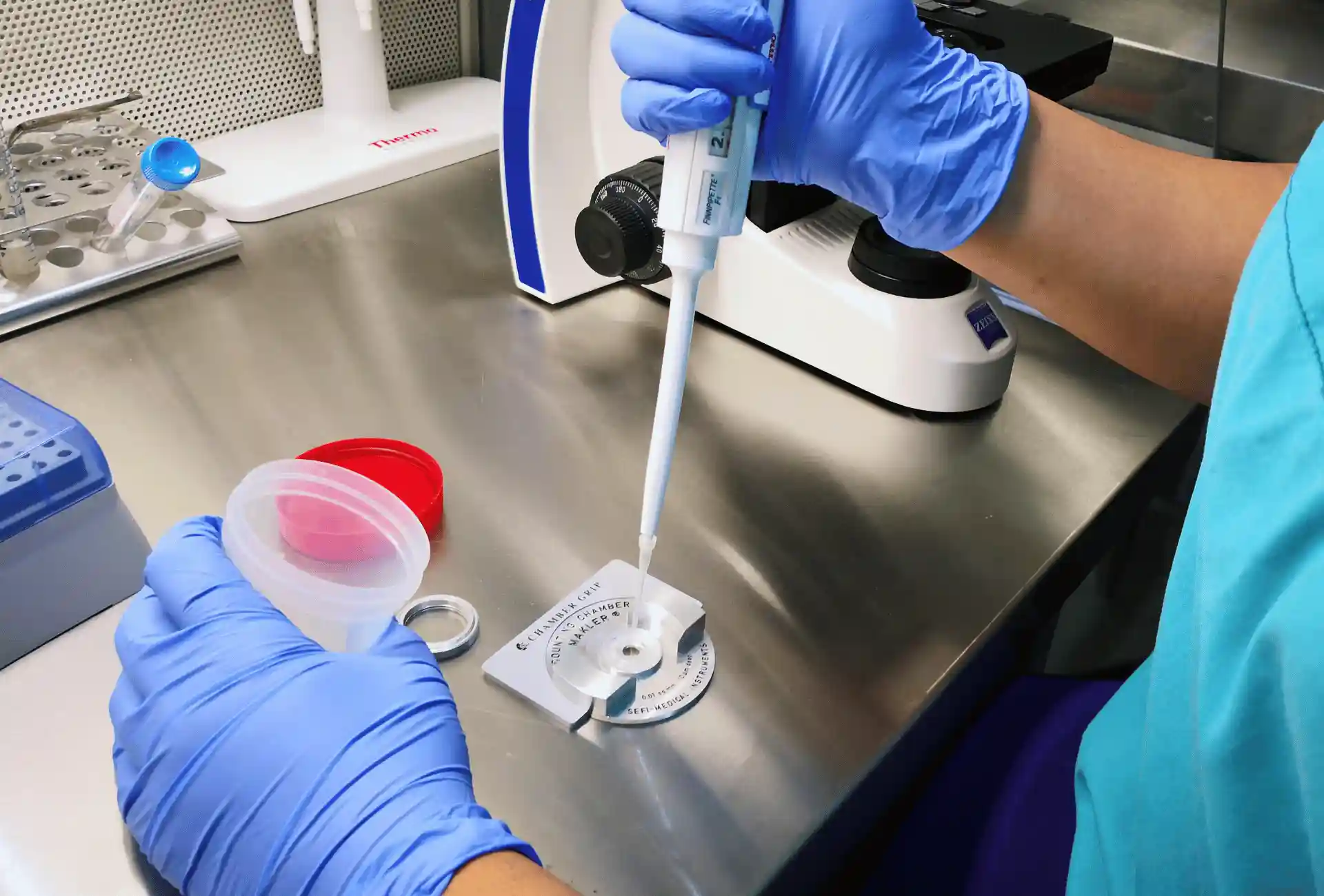
- Preparação para análise microscópica – homogenização, carregamento de câmaras (Makler), classificação da motilidade (tipos A–D)
- Contagem de concentração e cálculo do número total de espermatozoides – exercício prático com câmaras de contagem
- Testes de vitalidade – execução do teste de eosina-nigrosina: preparação do esfregaço, contagem de espermatozoides vivos e mortos
- Teste de peroxidase para células redondas – preparo do reagente, coloração da amostra e diferenciação entre leucócitos e outras células
- Morfologia estrita (Kruger) – preparação e coloração do esfregaço (Shorr ou Papanicolaou), uso de microscópio com imersão (1 000 ×), identificação de alterações de cabeça, peça intermediária e cauda, cálculo do percentual de formas normais
- Aplicação de técnicas complementares:
- Seleção de espermatozoides com ZyMot: manuseio da placa microfluídica, incubação da amostra, coleta dos espermatozoides selecionados e comparação com métodos tradicionais
- Teste de fragmentação do DNA: leitura e interpretação dos resultados
No items found.
NOSSOS CURSOS